miRAN 分析以及mRNA分析
一些参考资料
http://www.360doc.com/content/17/0528/22/19913717_658086490.shtml
https://www.cnblogs.com/triple-y/p/9338890.html
一、对miRNA进行分析
1、bowtie比对
"bowtie -q -v 2 -l 10 -k 15 /data/pub/shehb/Spinach_genome/spinach_genome_v1.fa "+fq+" -S "+fq+".sam >mapping.info"
2、HTSeq 计算reads数量 (详细:http://www.chenlianfu.com/?p=2438)
(1)HTSeq是对有参考基因组的转录组测序数据进行表达量分析的,其输入文件必须有SAM和GTF文件。
(2)一般情况下HTSeq得到的Counts结果会用于下一步不同样品间的基因表达量差异分析,而不是一个样品内部基因的表达量比较。因此,HTSeq设置了-a参数的默认值10,来忽略掉比对到多个位置的reads信息,其结果有利于后续的差异分析。
(3)输入的GTF文件中不能包含可变剪接信息,否则HTSeq会认为每个可变剪接都是单独的基因,导致能比对到多个可变剪接转录本上的reads的计算结果是ambiguous,从而不能计算到基因的count中。即使设置-i参数的值为transcript_id,其结果一样是不准确的,只是得到transcripts的表达量。
run = "htseq-count -s no -t mRNA -i ID "+sam+" ./Spinach_genome/spinach_gene_v1miRNA.gff3 > "+sam+"count_out.txt"
参数:
-f | --format default: sam 设置输入文件的格式,该参数的值可以是sam或bam
-r | --order default: name 设置sam或bam文件的排序方式,该参数的值可以是name或pos。,但HTSeq推荐使用name排序,且一般比对软件的默认输出结果也是按name进行排序的。
-s | --stranded default: yes 设置是否是链特异性测序。该参数的值可以是yes,no或reverse。no表示非链特异性测序;若是单端测序,yes表示read比对到了基因的正义链上;若是双末端测序,yes表示read1比对到了基因正义链上,read2比对到基因负义链上;reverse表示双末端测序情况下与yes值相反的结果。根据说明文件的理解,一般选择no, yes是成对的reads数量-a | --a default: 10 忽略比对质量低于此值的比对结果。在0.5.4版本以前该参数默认值是0。 -t | --type default: exon 程序会对该指定的feature(gtf/gff文件第三列)进行表达量计算,而gtf/gff文件中其它的feature都会被忽略。 比如:在mRNA中,选择exon,表示只计算exon的reads数量-i | --idattr default: gene_id 设置feature ID是由gtf/gff文件第9列那个标签决定的;若gtf/gff文件多行具有相同的feature ID,则它们来自同一个feature,程序会计算这些features的表达量之和赋给相应的feature ID。 看基因前面的标志是什么-m | --mode default: union 设置表达量计算模式。该参数的值可以有union, intersection-strict and intersection-nonempty。这三种模式的选择请见上面对这3种模式的示意图。从图中可知,对于原核生物,推荐使用intersection-strict模式;对于真核生物,推荐使用union模式。 -o | --samout 输出一个sam文件,该sam文件的比对结果中多了一个XF标签,表示该read比对到了某个feature上。 -q | --quiet 不输出程序运行的状态信息和警告信息。 -h | --help 输出帮助信息。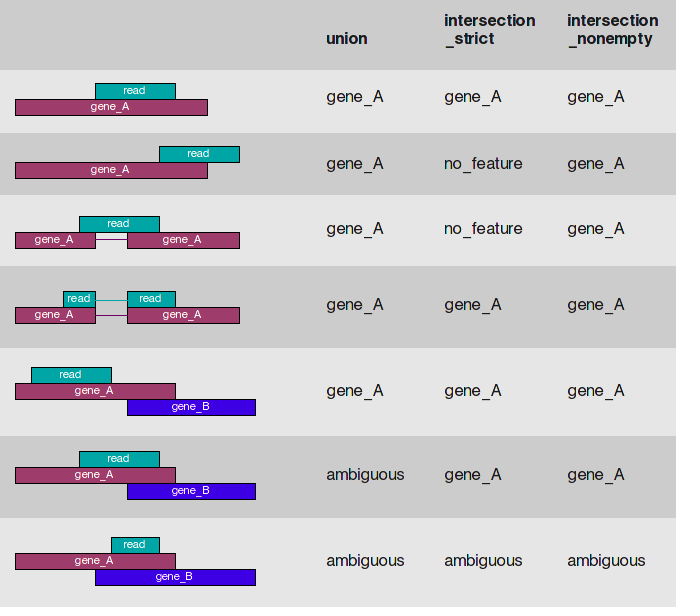
1 paste *.txt |awk '{printf $1"\t";for(i=2;i<=18;i+=2)printf $i"\t";printf $i"\n"}' |less -S
2
3 ##18 为总共有多少列
3、对于有重复的样本用DESeq2进行分析
自认为感觉不是很好安装包 ,我用下前面方法安装上去的
若R安装包出现package ‘xx’ is not available (for R version 3.4.2)的问题时:
用以下方法安装包
source("http://bioconductor.org/biocLite.R")
biocLite("包名")
DESeq2对于输入数据的要求
1.DEseq2要求输入数据是由整数组成的矩阵。
2.DESeq2要求矩阵是没有标准化的。
DESeq2进行差异表达分析
DESeq2包分析差异表达基因简单来说只有三步:构建dds矩阵,标准化,以及进行差异分析。
1、构建dds矩阵
需要:(1)countData, 是readscount计算后,合并的形成的矩阵。行为基因名字,列为样本
(2)colData, 样本信息,标出哪些是control,哪些是treat。第一列样品名称(其实就是countData第一行的名称),第二列是样品处理情况(对照还是处理等),condition的类型是一个factor。
(3)差异比较矩阵 即上述代码中的design。 差异比较矩阵就是告诉差异分析函数是要从要分析哪些变量间的差异,简单说就是说明哪些是对照哪些是处理。
library(S4Vectors)
library(stats4)
library(BiocGenerics)
library(parallel)
library(IRanges)
library(GenomicRanges)
library(GenomeInfoDb)
library(SummarizedExperiment)
library(Biobase)
library(DelayedArray)
library(matrixStats)
library(DelayedArray)
library(DESeq2)
library(ggplot2)
setwd("/Users/hongbingshe/Desktop")
condition <- factor(c("XX","XX","XX","XY","XY","XY"))
countData <- read.table("XX_XYmiRNA.count_out",header = T,sep = "\t",row.names = "X") ##open file
colData <- data.frame(row.names = colnames(countData),condition)
dds <- DESeqDataSetFromMatrix(countData,DataFrame(condition),design = ~ condition)
head(dds) ##
dds2 <- DESeq(dds) ###normalize rlogTransformation(dds2). ???
resultsNames(dds2) ###objective name
res <- results(dds2)
summary(res) ###infomation
table(res$padj<0.05) ##number of true 小于0.05 的基因个数
res <- res[order(res$padj),]
diff_gene_deseq2 <- subset(res,padj <0.05 & (log2FoldChange >1 |log2FoldChange < -1)) ###FC >1, P <0.05
differ_gene_deseq2 <- row.names(diff_gene_deseq2)
resdata <- merge(as.data.frame(res),as.data.frame(counts(dds2,normalize=TRUE)),by="row.names",sort=FALSE)
write.csv(resdata,file = "/Users/hongbingshe/Desktop/XX_XYmiRNA.cvs",row.names = F) ##output file
resdata[which(resdata$padj < 0.05 & resdata$log2FoldChange > 1 ),'significant'] <-'up'
resdata[which(resdata$padj < 0.05 & resdata$log2FoldChange < -1 ),'significant'] <-'down'
resdata[!resdata$significant%in%c('up','down'),'significant'] <- 'no'
p <- ggplot(resdata,aes(resdata$log2FoldChange,-log10(resdata$padj))) + geom_point(aes(color=significant),size=0.5) +scale_color_manual(limits=c('up','down','no'),values = c('blue','red','gray40')) +labs(x="log2(Fold Change)",y="-log10(P-value)")
p <- p + theme(panel.grid.major = element_line(color="gray",size=0.2), panel.background = element_rect(color = "black",fill = "transparent")) +geom_vline(xintercept = c(-1,1),color="gray",linetype=2,size=0.5)+geom_hline(yintercept = -log10(1),color='gray',linetype=2,size=0.5)
p <- p + theme(legend.title = element_blank(),legend.key = element_rect(fill='transparent'),legend.background = element_rect(fill = 'transparent'))
p <- p + xlim(-4,4) +ylim(0,40) ##X scale
p
ggsave("XY_XXmiRNAvalcano_plot.png",p,width = 4.5,height=5.5)
标记出你期望的基因名字
(1)首先需要做一个数据框. 假如为test
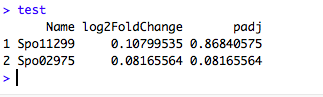
(2)导入 ggrepel 包
library(ggrepel)
(3)添加图层
p + geom_text_repel(data =test,aes(test$log2FoldChange,-log10(test$padj),label=test$Name))
或者用p +geom_label_repel(data = test,aes(test$log2FoldChange,-log10(test$padj),label=test$Name))
二、mRNA分析
选用hisat2+HTseq+DEseq2
1、hisat2:
run = "hisat2 -x ./Spinach_genome/spinach_genome_v1.fa -p 4 -1 "+i+" -2 "+j+" -S "+Out
2、HTSeq2
htseq-count -f bam -r name -s no -a 10 -t exon -i ID -m intersection-nonempty yourfile_name.bam ~/reference/hisat2_reference/Homo_sapiens.GRCh38.86.chr_patch_hapl_scaff.gtf > counts.txt
3、DEseq2
同上
关注下方公众号可获得更多精彩

miRAN 分析以及mRNA分析的更多相关文章
- 常用 Java 静态代码分析工具的分析与比较
常用 Java 静态代码分析工具的分析与比较 简介: 本文首先介绍了静态代码分析的基 本概念及主要技术,随后分别介绍了现有 4 种主流 Java 静态代码分析工具 (Checkstyle,FindBu ...
- Memcached源代码分析 - Memcached源代码分析之消息回应(3)
文章列表: <Memcached源代码分析 - Memcached源代码分析之基于Libevent的网络模型(1)> <Memcached源代码分析 - Memcached源代码分析 ...
- mysql 分析3使用分析sql 性能 show profiles ;
show variables like '%profiling%'; 查看状态 查看时间去哪了``` set profiling=1;// 打开 show profiles; 查看执行过的 ...
- [转载] 常用 Java 静态代码分析工具的分析与比较
转载自http://www.oschina.net/question/129540_23043 简介: 本文首先介绍了静态代码分析的基本概念及主要技术,随后分别介绍了现有 4 种主流 Java 静态代 ...
- x264源代码简单分析:宏块分析(Analysis)部分-帧间宏块(Inter)
===================================================== H.264源代码分析文章列表: [编码 - x264] x264源代码简单分析:概述 x26 ...
- x264源代码简单分析:宏块分析(Analysis)部分-帧内宏块(Intra)
===================================================== H.264源代码分析文章列表: [编码 - x264] x264源代码简单分析:概述 x26 ...
- loadrunner 结果分析-loadrunner结果分析
结果分析-loadrunner结果分析 by:授客 QQ:1033553122 百度网盘分享链接: 烦请 复制一下网址到浏览器中打开,输入密码提取 链接: http://pan.baidu.com/s ...
- ⑥NuPlayer播放源码分析之DecoderBase分析
NuPlayer播放源码分析之DecoderBase分析 [时间:2017-02] [状态:Open] [关键词:android,nuplayer,开源播放器,播放框架,DecoderBase,Med ...
- 【转载】常用 Java 静态代码分析工具的分析与比较
摘自:http://www.oschina.net/question/129540_23043常用 Java 静态代码分析工具的分析与比较 简介: 本文首先介绍了静态代码分析的基本概念及主要技术,随后 ...
随机推荐
- 剑指offer:JZ9 用两个栈实现队列
JZ9 用两个栈实现队列 描述 用两个栈来实现一个队列,使用n个元素来完成 n 次在队列尾部插入整数(push)和n次在队列头部删除整数(pop)的功能. 队列中的元素为int类型.保证操作合法,即保 ...
- 需求存在,功能存在——Alpha阶段性总结
0.Alpha开发成果 题士Alpha发布报告 题士开发记录 1.任务划分 Alpha阶段大致将任务划分为Design,Develop和Test三类 Design型任务包含页面UI设计和接口API设计 ...
- BF算法和KMP算法
这两天复习数据结构(严蔚敏版),记录第四章串中的两个重要算法,BF算法和KMP算法,博主主要学习Java,所以分析采用Java语言,后面会补上C语言的实现过程. 1.Brute-Force算法(暴力法 ...
- 2021CCPC网络赛(重赛)题解
自己还是太菜了,五个小时一个题也没磕出来,还是队友牛逼!... Primality Test 先看这个题,可能一上去就被\(\frac{f(x)+f(f(x))}{2}\)向下取整吓住了,但仔细想想, ...
- 就因为把int改成Integer,第2天被辞了
本文节选自<设计模式就该这样学>之享元模式(Flyweight Pattern) 1 故事背景 一个程序员就因为改了生产环境上的一个方法参数,把int型改成了Integer类型,因为涉及到 ...
- linux 安装rabbitmq
1.安装rabbitmq会依赖erlang.socat.unixodbc 下载 unixODBC-2.3.7.tar.gz ,创建路径/usr/local/unixODBC-2.3.7,解压到该路径下 ...
- 初步认识express,并创建web服务器,挂载静态资源
1.Express简介 1.1什么是Express 官方给出的概念:Express 是基于 Node.js 平台,快速.开放.极简的 Web 开发框架,官方网址 相似用途:Express 的作用和 N ...
- 【Python+postman接口自动化测试】(3)什么是接口测试?
什么是接口测试? 接口测试是测试系统组件间接口的一种测试.接口测试主要用于检测外部系统与系统之间以及内部各个子系统之间的交互点.测试的重点是要检查数据的交换.传递和控制管理过程,以及系统间的相互逻辑依 ...
- Linux usb 4. Device 详解
文章目录 1. 简介 2. Platform Layer 2.1 Platform Device 2.2 Platform Driver 3. UDC/Gadget Layer 3.1 Gadget ...
- find 删除日志文件
find 命令删除日志文件 find ./my_dir -mtime +10 -type f -delete EXPLANATIONS ./my_dir your directory (replace ...
